Принцип работы батарейки
Как работают настенные часы, пульт от телевизора или детская игрушка на радиоуправлении? Большинство людей, не задумываясь, ответят — «от батареек» и будут, в принципе, правы. Но вряд ли кто-то из них сможет рассказать, как именно портативный элемент питания утроен, каким образом он функционирует и без чего весь процесс передачи электрического тока от батарейки к конечному потребителю был бы невозможен. Давайте же восполним этот досадный пробел в знаниях.
Содержание статьи
Принцип работы батарейки
Для того чтобы понять принцип функционирования обычной «пальчиковой» батарейки, необходимо иметь общее представление о её устройстве. Итак, любая батарейка состоит из трёх основных элементов — анода, катода и электролита. При этом последний может иметь фактически любое агрегатное состояние: помещённые в соляной раствор катод и анод, в принципе, так же являются «батарейкой», только в непривычном для рядового обывателя виде.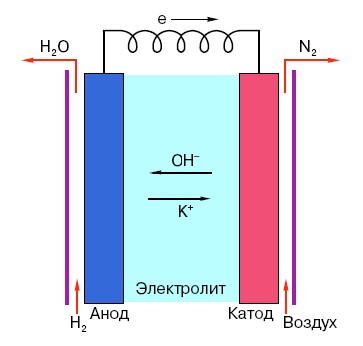
Интересно! Так называемый «вольтов столб», изобретённый Алессандро Вольта, так же имел все необходимые для производства электротока элементы. Он состоял из уложенных друг на друга цинковых и медных пластин, между которыми в качестве «прослойки» помещалась смоченная в кислоте ткань.
Анод в подобных системах – это главный источник электронов, которые, как мы знаем из школьного курса физики, имеют отрицательный заряд. Отрицательно заряженные частицы притягиваются к положительным, а в качестве «плюса» в данном случае выступает поверхность катода.
Но для возникновения электротока этого мало, ведь электронам нужна ещё и своеобразная «магистраль» — среда, которая поддерживала бы взаимодействие катода и анода. Именно здесь «на сцене» появляется электролит – соль, щёлочь или кислота, способные проводить ток.
Разберём принцип действия на конкретном примере: имеется элемент питания, рассчитанный на 18 вольт. Напряжение между электродами в нём стабильно, пока он не включён в сеть. Как только появляется потребитель (к примеру, обычная лампочка), напряжение начинает постепенно снижаться, от «минусового» электрода к «плюсовому» начнёт течь ток, и в электролите произойдёт химическая реакция, направленная на поддержание разности потенциалов между электродами.
Справка. Чем больше энергии требуется потребителю, тем интенсивнее течёт реакция внутри элемента питания и тем быстрее он выйдет из строя.
Как работает аккумуляторная батарейка, её отличие от обычной
Итак, мы рассмотрели классические «пальчиковые» и «мизинчиковые» элементы питания и знаем, что срок службы большинства из них строго ограничен (что бы там ни говорили именитые производители). Но как же быть с так называемыми АКБ – элементами питания аккумуляторного типа, способными не только расходовать энергию в процессе реакции, но и накапливать её и сохранять в течение долгого времени?
Для того чтобы понять принцип работы АКБ, необходимо обратиться к химии. В качестве примера возьмём… Обычный костёр на углях. Как бы красиво и завораживающе ни выглядело пламя, любой химик, наблюдая его, знает, что данный процесс представляет собой всего лишь длительную реакцию окисления топлива. Горящий уголь взаимодействует с кислородом и в качестве результата такой реакции мы получаем:
- углекислый газ;
- свет;
- тепло.
И если последние два пункта способны согреть душу и тело, то вот как-либо использовать углекислый газ мы не можем, ведь это побочный продукт реакции, являющийся, по сути, её отходом. Реакция окисления прекращается тогда, когда заканчиваются исходные элементы: кислород и уголь. Остановка реакции в батарейке происходит точно так же, когда исходные вещества полностью себя исчерпывают и остаются только «отходы».
В АКБ же всё происходит немного не так. Дело в том, что реакция, протекающая в ней, относится к разряду обратимых, то есть при определённых условиях её можно «повернуть вспять», вернув все вещества в их исходное состояние. Именно возможность протекания обратимой реакции в аккумуляторе позволяет заряжать его.
В АКБ, подключенной к сети, реакция протекает в обратном направлении, и ток идёт от «плюса» к «минусу», а не наоборот. Как результат – продукт реакции образует исходные вещества, а хозяин АКБ получает доступную «восстановленную» энергию в портативном формате. Вот и всё!







